東京理科大学発の新規物質を用いた創薬研究
画期的な構造変換技術の開発
人類が医薬品として利用する物質のほとんどは、炭素を基本とした有機化合物からできていて、複数の化学反応を組み合わせることで合成されます。しかし、目的の化合物を作るまでに何段階もの反応を行わなければならない場合、時間と手間がかかるうえに、膨大な量の廃棄物が出るため、環境に負荷がかかります。創薬研究開発センターではまず第一の課題として、医薬品の合成収率を極限まで向上させる反応手法の研究を行っています。
例えばその成果として、抗生物質や抗がん剤の生産効率を劇的に高める新たな脱水縮合剤「2-メチル-6- ニトロ安息香酸無水物(MNBA)」を開発しました。脱水縮合反応とは、有機化合物から2 つの水素原子と1 つの酸素原子を一度に取り除き、2 つの物質を連結させる構造変換法で、その反応を起こさせる試薬が脱水縮合剤です。脱水縮合反応は、古くから医薬品の基本骨格を組み上げる際に利用されてきましたが、従来の方法では触媒に酸を用いたり、高温で処理するなどの過酷な反応条件を必要とするため、原料となる物質を破壊してしまうなどの問題がありました。椎名研究室では徹底的に化合物や反応条件の探索を行い、世界最速の脱水縮合反応剤であるMNBA を発明することに成功しました。その後MNBA は、新型抗生物質や分子標的抗がん剤、糖尿病治療薬の合成などに幅広く活用され、すでに全世界で19,000 件を超える使用実績が報告されています(図1)。また現在は次世代の新型脱水縮合剤として、「2-フルオロ-6-トリフルオロメチル安息香酸無水物(FTFBA)」の製造にも成功しています。

がんの抑制に新手法 (タンパク質輸送ブロッカー M-COPA の全合成)
本センターにおいて、この「反応手法の開発」と両輪をなすのが「全合成」の研究です。全合成とは、複雑な分子構造をもつ天然由来の化学物質などを、最小単位である原料レベルから人工的に合成することです。例えば、土壌に生息する細菌から抽出される希少な化学物質の中には、抗がん作用を示すものがあります。このような物質を人工的に合成できれば、薬の安定生産に結びつくだけでなく、副作用を抑えるなど、医薬品として最適な化学構造にデザインすることもできます。全合成の分野では、MNBA を用いて抗がん活性を持つ有機化合物の合成研究に力を入れています。
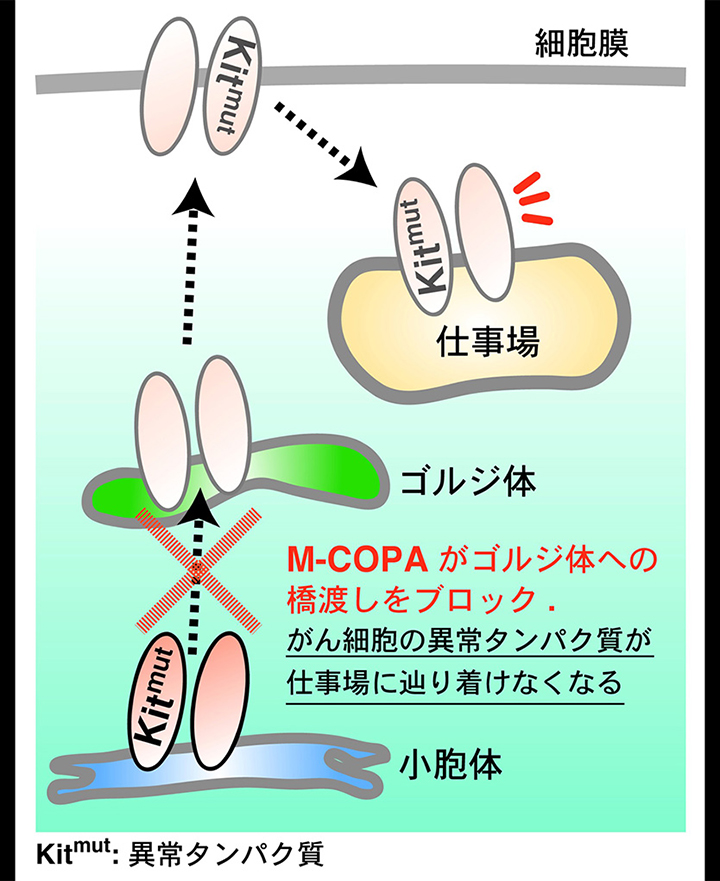
私たちが全合成を行ったM-COPA は、細胞内のタンパク質輸送を司るゴルジ体の働きを制限します。ゴルジ体によって活性化しているがん細胞にこの化合物を与え輸送経路を遮断し、がんの増殖を抑制しようという試み(図2)が国内外の研究機関で進められています。本センターの合成グループでは、生物活性評価グループが動物実験にM-COPA を使用するため、その大規模製造法の開発に取り組みました。
我々は7 つの連続する不斉炭素を有するM-COPA をグラムスケール以上で供給できるように各工程を検討し、実際に鍵反応である不斉アルドール反応、分子内Diels−Alder 反応、MNBA 脱水縮合反応等の有機合成法を駆使して大量合成を可能にすることができました。全合成された化合物を用いてがん細胞への効果を検証する実験が行われ、もはや既存の抗がん剤では治せないと考えられていた耐性化したがんでさえも、その増殖が食い止められる等の顕著な成果が論文として続々と報告されています。工業利用までの展開を見越して合成法を設計した点が、今回の目的を達成できた要の部分と考えています。YouTube による研究内容の公開も行っていますので、「M-COPA YouTube」、「AMF-26 YouTube」などで検索し、成果をご覧ください。